A teoria de Demócrito
A teoria dos átomos de Demócrito foi proposta no século V a.C. e é considerada uma das mais antigas teorias científicas sobre a natureza da matéria. Ela foi baseada na filosofia naturalista da Grécia Antiga, que procurava explicar a natureza da realidade através da lógica e da razão, sem recorrer às mitologias ou religiões.
Demócrito acreditava que a matéria era composta por partículas extremamente pequenas, que ele chamou de átomos, que eram impenetráveis e indivisíveis. Ele argumentou que esses átomos eram organizados de forma diferente para formar diferentes tipos de materiais, como pedra, madeira, metal, entre outros. Além disso, Demócrito acreditava que a combinação de átomos diferentes poderia criar novas propriedades e que a sensação de calor e frio eram resultados da vibração dos átomos.
A teoria dos átomos de Demócrito foi uma das primeiras tentativas de explicar a natureza da matéria e teve um grande impacto na filosofia naturalista da Grécia Antiga. No entanto, sua teoria não foi baseada em experimentos ou observações, mas em argumentos filosóficos, o que a tornou uma teoria especulativa, sem provas concretas.
Foi somente muitos séculos depois, com o desenvolvimento da ciência moderna e dos experimentos, que a teoria dos átomos foi comprovada e tornou-se uma parte fundamental da física e da química. No entanto, a contribuição de Demócrito para o conhecimento da natureza da matéria é inestimável e ele é considerado um dos precursores da ciência moderna.
A teoria de Dalton
John Dalton, um cientista britânico nascido em 1766, foi um dos primeiros a desenvolver uma teoria atômica rigorosa. Ele baseou sua teoria em experimentos e observações que realizou, incluindo o estudo de propriedades de diferentes gases, a análise de reações químicas e o uso de balanços químicos para medir as quantidades de reagentes e produtos envolvidos em uma reação.
Dalton propôs que cada elemento químico é composto por átomos idênticos em massa e tamanho, e que os átomos diferem entre os elementos. Ele também sugeriu que os átomos podem se combinar para formar moléculas, e que as propriedades químicas de uma substância são determinadas pelo número e tipo de átomos presentes na molécula.
Além disso, Dalton propôs que as reações químicas ocorrem quando os átomos se combinam ou se separam para formar novas moléculas. Ele também desenvolveu a ideia de que os átomos podem se combinar em proporções fixas, o que é conhecido como a Lei de Proporções Definidas.
A teoria atômica de Dalton forneceu a base para o entendimento posterior da estrutura atômica e da química moderna. Suas ideias revolucionaram a compreensão da matéria e abriram caminho para o desenvolvimento de novos conceitos e teorias na química e em outras áreas da ciência. Até hoje, a teoria atômica de Dalton é amplamente aceita e estudada em cursos de química em todo o mundo.
A teoria de Thomson
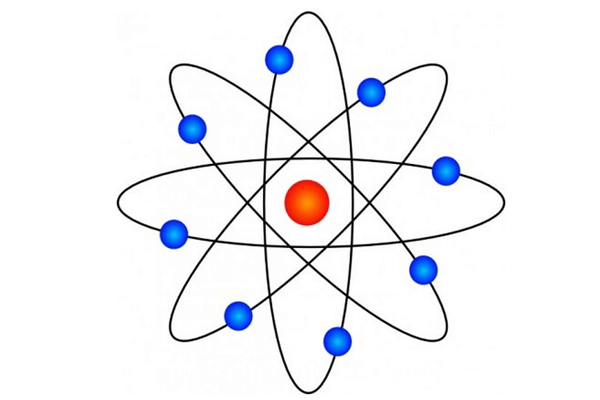
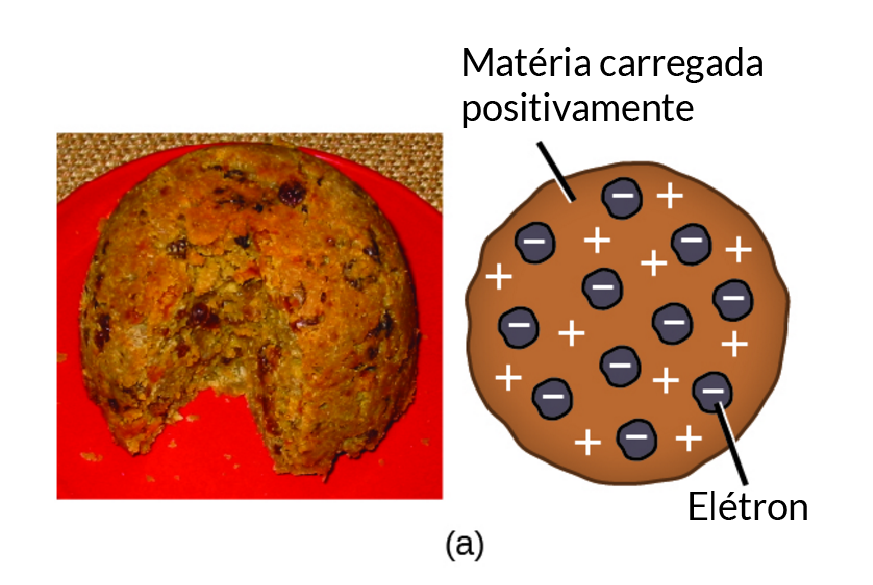
JJ Thomson, físico britânico, realizou experimentos com descargas elétricas que forneceram a primeira prova da existência dos átomos. Ele desenvolveu o modelo do átomo como uma esfera positiva, com elétrons negativos movendo-se ao redor da esfera como planetas em órbita em torno do sol.
Em 1897, ele realizou o experimento de raio-c cathódico, no qual ele passou um raio de elétrons através de uma fina tela de metal para uma tela fluorescente. Isso permitiu que ele determinasse a carga dos elétrons e sua massa. Ele descobriu que a massa dos elétrons era muito menor que a dos átomos, sugerindo que os átomos eram compostos por partículas positivas e negativas.
Esta descoberta revolucionou a compreensão da natureza da matéria e foi fundamental para o desenvolvimento da física atômica e da química moderna. A teoria de Thomson sobre os átomos foi posteriormente modificada e ampliada por outros cientistas, mas sua contribuição inicial para a compreensão da estrutura atômica é inegável.
A teoria de Rutherford
O experimento de Rutherford foi realizado por Ernest Rutherford no início do século 20. Ele usou partículas alfa para atirar em uma folha fina de ouro e registrar sua trajetória. O resultado surpreendente foi que a maioria das partículas alfa passou diretamente através da folha de ouro sem ser desviada, mas algumas foram desviadas de forma significativa.
A partir deste experimento, Rutherford desenvolveu seu modelo atômico, que descreveu o átomo como uma estrutura composta por um núcleo central pesado, composto por prótons positivos e nêutrons, cercado por elétrons negativos em círculo. O núcleo, que é muito menor em comparação com o tamanho total do átomo, contém a maior parte da massa atômica.
Esse modelo explicou por que a maioria das partículas alfa passou diretamente através da folha de ouro sem ser desviada: o núcleo era muito pequeno em relação ao tamanho total do átomo, então a maioria das partículas alfa não interagiu com ele. No entanto, algumas partículas alfa foram fortemente desviadas porque entraram em colisão com o núcleo.
Este modelo atômico de Rutherford foi uma grande contribuição para a compreensão da natureza da matéria, pois mostrou que o átomo não era uma estrutura uniforme e indivisível, como se acreditava antes, mas sim uma estrutura complexa composta por partículas subatômicas diferentes. Além disso, estabeleceu a existência do núcleo atômico e estabeleceu a presença de partículas positivas e negativas dentro do átomo.A teoria de Bohr
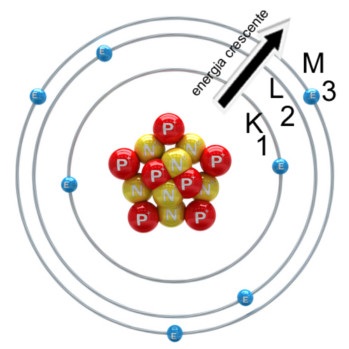
Finalmente, Niels Bohr foi um físico dinamarquês que teve um impacto significativo na compreensão da natureza da matéria e da radiação. Ele propôs um modelo atômico que se tornou conhecido como o modelo de Bohr.
De acordo com o modelo de Bohr, os elétrons estavam concentrados em níveis específicos de energia, conhecidos como níveis de quantização, ao redor do núcleo. Estes níveis eram descritos por números quânticos, e cada nível correspondia a uma distância específica do núcleo. Os elétrons só podiam existir em níveis bem definidos de energia, e para mudar de um nível para outro, eles precisavam ganhar ou perder energia.
Bohr também propôs que a transição entre níveis de energia ocorria com a emissão ou absorção de luz. Quando um elétron mudava de um nível de energia para outro, ele emitia ou absorvia energia na forma de fótons, e essas transições eram responsáveis por muitos fenômenos ópticos, incluindo a cor da luz emitida por uma substância.O modelo de Bohr revolucionou a compreensão da estrutura dos átomos e forneceu uma base teórica sólida para a compreensão de muitos fenômenos químicos e ópticos. Embora tenha sido posteriormente corrigido e melhorado, ainda é amplamente utilizado como base para o entendimento da física atômica.
Conclusão: compreendendo o mundo à nossa volta.
A estrutura do átomo é composta por três tipos de partículas subatômicas: prótons, nêutrons e elétrons. Os prótons são partículas importantes no núcleo do átomo, sendo a carga positiva responsável por manter as outras partículas - os nêutrons e elétrons - em suas respectivas órbitas. Já os nêutrons são responsáveis por manter a estabilidade do núcleo, pois possuem massa sem carga elétrica. Por fim, os elétrons são as partículas responsáveis pela carga elétrica negativa, girando em volta do núcleo em suas órbitas conhecidas como níveis energéticos.
Além disso, é importante destacar a importância da estrutura do átomo para as características químicas dos elementos. A quantidade de prótons presentes em um átomo é responsável por determinar o elemento químico ao qual ele pertence, e a configuração dos elétrons em seus níveis energéticos influencia na forma como os átomos se unem para formar moléculas e compostos químicos.
Em resumo, a evolução dos modelos atômicos e a compreensão da estrutura do átomo são fundamentais para a compreensão da química e do mundo que nos cerca. Por isso, é importante conhecer as contribuições dos colaboradores dessas teorias e entender a estrutura e comportamento dos átomos.


Comentários
Postar um comentário